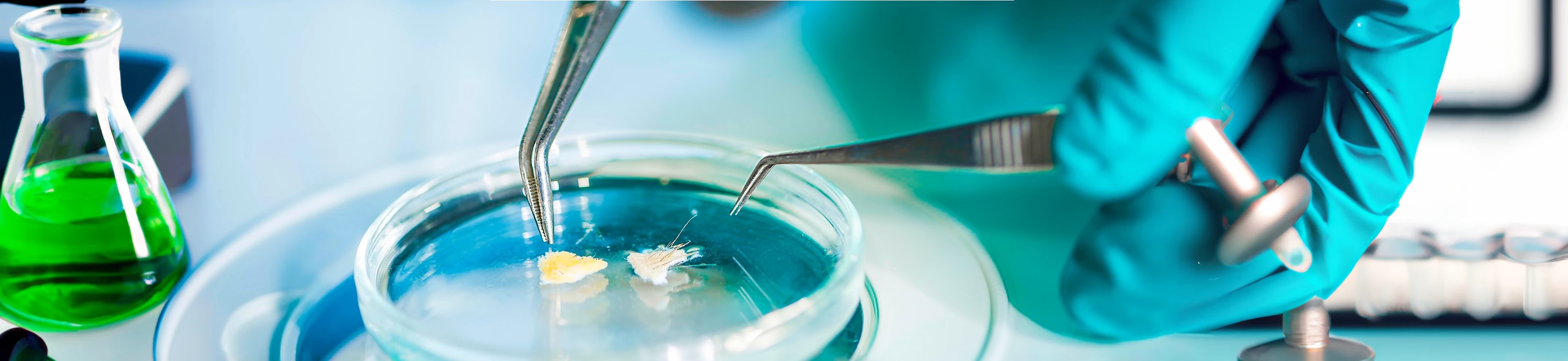
[Inno 360°] Minimal ingredients, maximal tolerance 🤩
➡️ Discover the sterile cosmetics, a Pierre Fabre Laboratories innovation 👏
Découvrez
Nos marques
Découvrez
Nos marques
Notre double expertise pharmaceutique et dermo-cosmétique nous permet de privilégier une approche globale du soin : prévenir, traiter, accompagner.



Focus sur
Nos engagements
Focus sur
Nos engagements
Green Mission Pierre Fabre est l’engagement éco-socio-responsable du groupe Pierre Fabre, évalué par le label Engagé RSE d’AFNOR Certification au niveau Exemplaire. C’est notre conviction, notre dynamique pour innover durablement au bénéfice de la Nature et des Hommes, une démarche déployée autour de 5 enjeux.
Innover
Protéger
Respecter
Garantir
Engager

Envie d'une entreprise
qui vous ressemble ?
Envie d'une entreprise
qui vous ressemble ?
Rejoindre le groupe Pierre Fabre, c’est entrer dans une entreprise à l’histoire riche de valeurs, d’innovations et d’expertises au service des patients et des consommateurs. Alors n’attendez plus : consultez nos offres, postulez et embarquez dans une aventure humaine !
Nos dernières
Actualités
Nos dernières
Actualités
Curieux d’en savoir plus sur notre entreprise? Retrouvez les dernières innovations de nos marques, nos engagements phares et les faits marquants de la vie du Groupe.